Tìm theo
Danh mục
Xem tất cả-
-
Tán Lục Giác (472)
-
Tán Hàn - Weldnut (33)
-
Tán Keo - Lock Nut (227)
-
Tán Khía - Flange Nut (50)
-
 Tán Dài (3)
Tán Dài (3)
-
Tán Bầu (39)
-
Tán Khóa (58)
-
Tán Cánh Chuồn (17)
-
Tán Cài (6)
-
Tán Vuông (11)
-
Vú Mỡ (Nipple Grease) (23)
-
Nut-With Knurled Heads (24)
-
Quick-Lock Nuts (16)
-
Blocks for Adjusting Bolts (207)
-
Threaded Stopper Blocks (52)
-
Bearing Lock Nuts (78)
-
-
-
Lông Đền Phẳng - Flat Washer (315)
-
Lông Đền Vênh - Spring Washer (244)
-
Lông Đền Vuông (25)
-
Lông Đền Răng (91)
-
Lông Đền Răng Cưa (77)
-
Lông Đền Nord-Lock (95)
-
Lông Đền Heico-Lock (101)
-
Lông Đền Vênh Loại Lượn Sóng (7)
-
Lông Đền Lượn Sóng (15)
-
Lông Đền Lò Xo Đĩa (25)
-
Lông Đền Chén (1)
-
 Lông Đền Cầu (5)
Lông Đền Cầu (5)
-
Lông Đền Làm Kín (Dạng Phớt) (4)
-
-
-
Gối Đỡ Vòng Bi UCP (66)
-
Gối Đỡ Vòng Bi UCF (49)
-
Gối Đỡ Vòng Bi UCPA (6)
-
Gối Đỡ Vòng Bi UCFC (14)
-
Gối Đỡ Vòng Bi UCFL (25)
-
Gối Đỡ Vòng Bi UCFK (3)
-
Gối Đỡ Vòng Bi UCT (18)
-
Gối Đỡ Vòng Bi Đũa Mặt Bích Vuông UCF (1)
-
Gối Đỡ UCHA (2)
-
Vòng Bi UC (40)
-
Vòng Bi UK (2)
-
Vỏ Gối Đỡ (22)
-
Phụ Kiện Gối Đỡ (27)
-
 Gối Đỡ Khác (2)
Gối Đỡ Khác (2)
-
-
-
Con Lăn Bi Loại Ép Chặt (24)
-
Con Lăn Bi Loại Thân Lục Giác (22)
-
Con Lăn Bi Loại Thân Tròn (5)
-
Con Lăn Bi Loại Đế Mặt Bích (4)
-
Con Lăn Bi Loại Đinh Tán Đầu Tròn (4)
-
Con Lăn Bi Loại Vít Cấy (12)
-
Con Lăn Bi Loại Đẩy Bi Có Ren (3)
-
Con Lăn Bi Loại Đẩy Bi Không Ren (3)
-
Ball Rollers Press (1)
-
Ball Plungers Roller (10)
-
Press Fit Plungers Roller (6)
-
-
-
Đầu Nối Nhanh Khí Nén Thẳng (1340)
-
Đầu Nối Nhanh Khí Nén Thẳng - Có Ren (2935)
-
Đầu Nối Nhanh Khí Nén Cong (585)
-
Đầu Nối Nhanh Khí Nén Cong - Có Ren (2995)
-
Đầu Nối Nhanh Khí Nén Chữ Y (475)
-
Đầu Nối Nhanh Khí Nén Chữ Y - Có Ren (557)
-
Đầu Nối Nhanh Khí Nén Chữ T (514)
-
Đầu Nối Nhanh Khí Nén Chữ T - Có Ren (1790)
-
Đầu Nối Nhanh Khí Nén Chữ Thập (70)
-
Đầu Nối Nhanh Khí Nén Lắp Vách (106)
-
Đầu Nối Khí Nén Kim Loại (1)
-


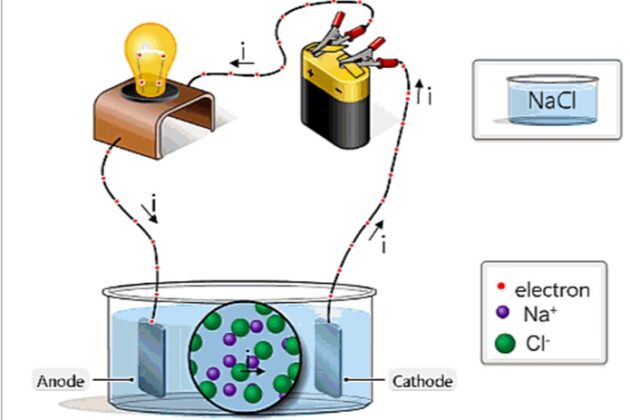
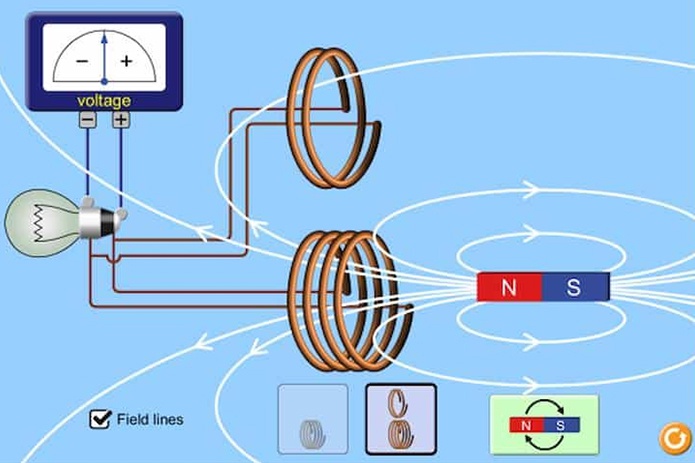
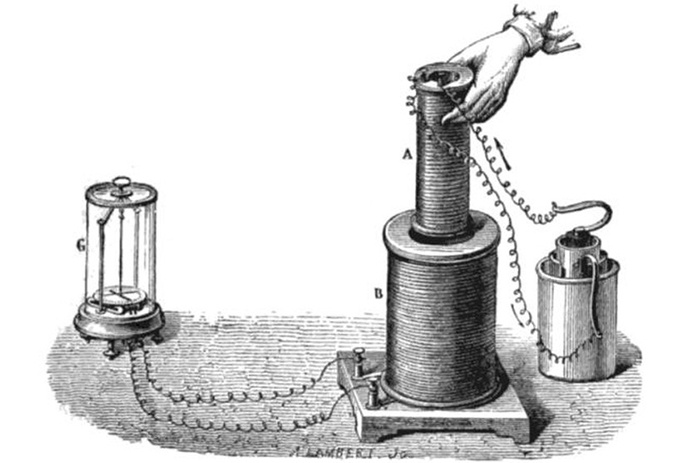

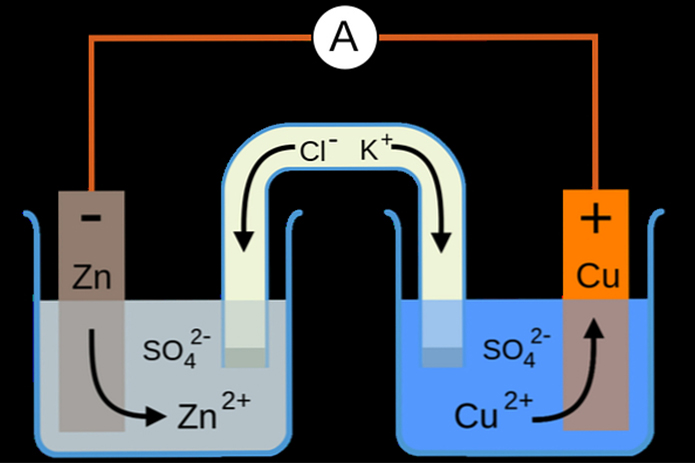
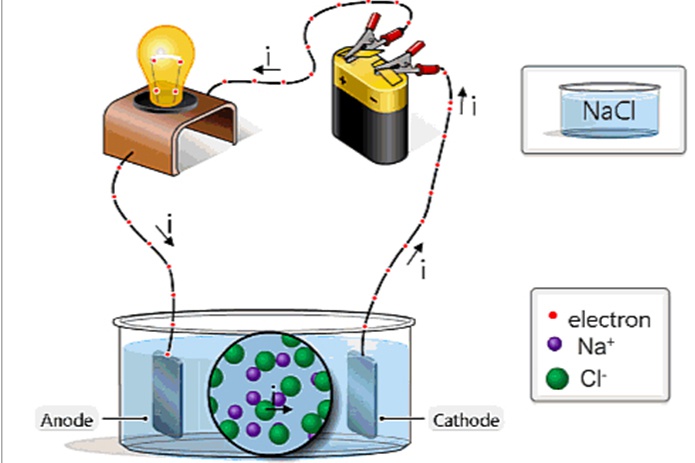
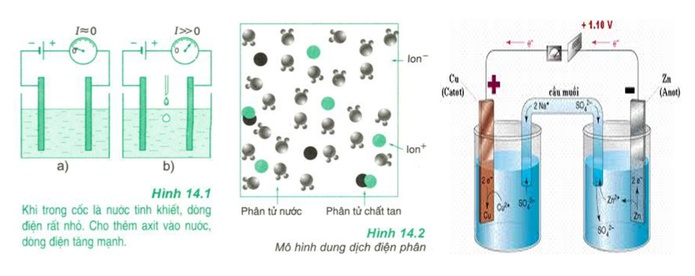






![Ốc Inox 304 là gì? Tất tần tật về Bulong, Vít Inox 304 [Tiêu chuẩn & Phân loại]](http://cms.mecsu.vn/uploads/media/2025/11/bulong dau luc giac inox 304 3.jpg)


