Dung dịch nước muối là dung dịch có thể dẫn điện và người ta gọi dung dịch đó là một chất điện li. Vậy nó là gì? Chúng được phân loại và đặc điểm như thế nào? Hôm nay, anh em hãy cùng mình tìm hiểu những thông tin này qua bài viết dưới đây nhé:
Chất điện li là gì?
Chất điện li còn được gọi là chất điện giải, chất điện phân, hay gọi tiếng anh là electrolyte. Đây là những chất tan được trong nước và chúng phân li tạo ra các ion âm hoặc ion dương. Một số chất mà anh em co thể thường gặp như: axit, bazơ và muối.

Quá trình phân li của các chất điện li trong nước (hoặc khi nóng chảy) để tạo ra ion thì được gọi là sự điện li.

Cơ chế của quá trình điện li các hợp chất: Khi cho hợp chất vào dung dịch nước. Lúc này sẽ có sự tương tác giữa phân tử nước với phân tử hợp chất.
Trong đó: Phân tử mang điện tích âm của chất điện li sẽ kết hợp với phân tử mang điện tích dương của dung dịch nước và ngược lại.

Quá trình tương tác này cùng với sự chuyển động không ngừng của các phân tử nước sẽ tạo ra sự điện li các phân tử điện li thành các ion mang điện tích âm và dương trong dung dịch nước.
Những hợp chất như: glixerol, ancol etylic,… không được coi là chất điện li vì trong phân tử của chúng dù có liên kết phân cực nhưng lại rất yếu, vì vậy dưới tác động của phân tử nước, chúng cũng không thể phân li tạo ra các ion được.
→ Thuyết điện li
Trong dung dịch hoà tan, các hợp chất hóa học như bazo, axit và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) được tích điện gọi là ion. Các ion này có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
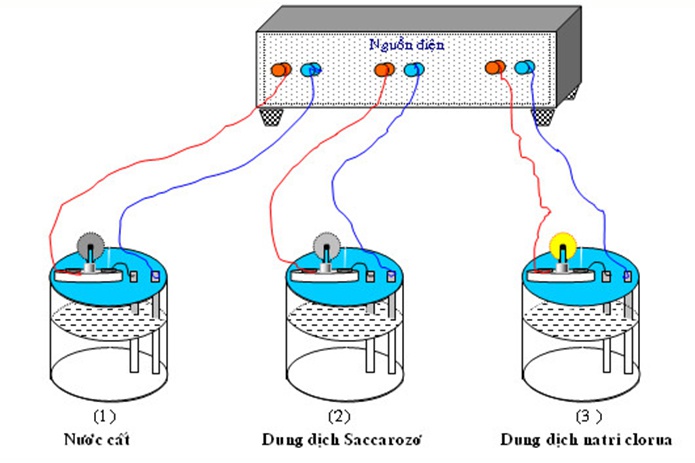
Ion gồm hai loại:
- Cation: là các ion mang điện tích dương của phần tử. Nó là các ion kim loại, ion H+ hoặc một số nhóm nguyên tử khác.
- Anion: là các ion mang điện tích âm của phần tử thường là gốc axit hoặc nhóm (OH)

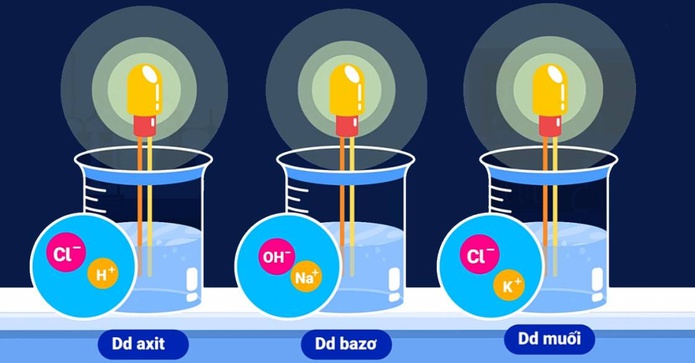
Sự phân li của một số chất tạo ra ion:
- Axit khi phân li sẽ tạo: gốc axit (ion âm) và H+
- Bazo khi phân li sẽ tạo: OH– (ion âm) + ion dương (kim loại)
- Muối khi phân li sẽ tạo: gốc axit (ion âm) + ion dương (kim loại)
- Một số bazơ không chứa ion kim loại nhưng cũng bị phân li tạo thành ion trong dung dịch
Có bao nhiêu loại chất điện li?
Chúng được chia làm 02 dạng chính là: dạng điện li mạnh và chất điện li yếu, ta cùng tìm hiểu chi tiết dưới đây:
→ Dạng yếu
Đây là chất mà khi tan trong dung dịch nước, nó chỉ có một số phân tử hòa tan phân li tạo ra ion, phần còn lại vẫn tồn tại ở dạng phân tử của chất trong dung dịch. Chất yếu gồm: các axit yếu (H2S, H2CO3, H3PO4,…), baza yếu không tan (Mg(OH)2, Fe(OH)2, Fe(OH)3,….)
Chúng được đánh giá bằng đại lượng độ điện li α và được tính bằng công thức: α = số phân tử phân li/tổng số phân tử hoà tan trong dung dịch. Độ điện li của chất điện li yếu thường dao động trong khoảng 0 < α < 1.

Phương trình điện li của các chất yếu thường sử dụng dấu mũi tên 02 chiều để biểu thị .
Ví dụ: Mg(OH)2 ⇌ Mg2+ + 2OH-
Sự điện li của chất điện li yếu được diễn ra là một quá trình thuận nghịch. Để thiết lập được sự cân bằng điện li thì tốc độ phân li ra ion và tốc độ kết hợp các ion thành phân tử phải bằng nhau.
→ Dạng mạnh
Chất điện li mạnh là chất khi được cho vào dung dịch nước thì tất cả các phân tử này sẽ hòa tan và phân li ra thành các ion tự do.
Với chất mạnh là các axit mạnh (như: HCl, H2SO4,….), các bazo mạnh (NaOH, Ba(OH)2,….) và phần lớn các muối.

Với chất điện li mạnh thì có α = 1. Khác với chất yếu, phương trình điện li của của nó dùng dấu mũi tên 01 chiều để chỉ chiều của quá trình điện li.
Ví dụ: H2SO4 ⭢ 2H++ SO42-
Bài tập lý thuyết về chất điện li

Bài 1: Câu trả lời nào trong các câu dưới đây là đúng.
Dung dịch chất điện li dẫn điện được là nhờ:
- Sự di chuyển của các electron.
- Sự di chuyển của các cation.
- Sự di chuyển của các phân tử được hoà tan.
- Sự di chuyển của hai cation và anion.
Đáp án: D. Sự di chuyển của hai cation và anion.
Vì khi hoà tan trong dung dịch (trong nước) các phân tử electrolyte sẽ phân li ra thành các cation và anion.
Bài 2: Hợp chất nào dưới đây là không dẫn điện?
- KCl rắn, khan.
- CaCl2 nóng chảy.
- NaOH nóng chảy.
- HBr hoà tan trong nước.
Đáp án: A. KCl rắn, khan.
Vì KCl rắn, khan ở dưới dạng mạng tinh thể ion rất khó phá vỡ cấu trúc. Vì vậy nó sẽ không phân li ra được ion dương và ion âm (di chuyển tự do) nên không có khả năng dẫn điện.

>>> 100+ Mã Sản Phẩm Dây Rút: https://mecsu.vn/san-pham/day-rut-nhua.5op
>>> 1000+ Mã Sản Phẩm Đầu Cosse: https://mecsu.vn/san-pham/dau-cosse.Q1j
Mời anh em xem thêm nhé:
Hy vọng với bài viết này sẽ giúp nhiều anh em có cái nhìn tổng quát hơn về chất điện li. Mọi thắc mắc hay cần giải đáp câu hỏi gì, anh em hãy để lại bên dưới phần bình luận nhé.

Tán Lục Giác (472)
Tán Hàn - Weldnut (33)
Tán Keo - Lock Nut (227)
Tán Khía - Flange Nut (50)
 Tán Dài (3)
Tán Dài (3)
Tán Bầu (39)
Tán Khóa (58)
Tán Cánh Chuồn (17)
Tán Cài (6)
Tán Vuông (11)
Vú Mỡ (Nipple Grease) (23)
Nut-With Knurled Heads (24)
Quick-Lock Nuts (16)
Blocks for Adjusting Bolts (207)
Threaded Stopper Blocks (52)
Bearing Lock Nuts (78)
Lông Đền Phẳng - Flat Washer (315)
Lông Đền Vênh - Spring Washer (244)
Lông Đền Vuông (25)
Lông Đền Răng (91)
Lông Đền Răng Cưa (77)
Lông Đền Nord-Lock (95)
Lông Đền Heico-Lock (101)
Lông Đền Vênh Loại Lượn Sóng (7)
Lông Đền Lượn Sóng (15)
Lông Đền Lò Xo Đĩa (25)
Lông Đền Chén (1)
 Lông Đền Cầu (5)
Lông Đền Cầu (5)
Lông Đền Làm Kín (Dạng Phớt) (4)
Con Lăn Bi Loại Ép Chặt (24)
Con Lăn Bi Loại Thân Lục Giác (22)
Con Lăn Bi Loại Thân Tròn (5)
Con Lăn Bi Loại Đế Mặt Bích (4)
Con Lăn Bi Loại Đinh Tán Đầu Tròn (4)
Con Lăn Bi Loại Vít Cấy (12)
Con Lăn Bi Loại Đẩy Bi Có Ren (3)
Con Lăn Bi Loại Đẩy Bi Không Ren (3)
Ball Rollers Press (1)
Ball Plungers Roller (10)
Press Fit Plungers Roller (6)
Đầu Nối Nhanh Khí Nén Thẳng (1340)
Đầu Nối Nhanh Khí Nén Thẳng - Có Ren (2935)
Đầu Nối Nhanh Khí Nén Cong (585)
Đầu Nối Nhanh Khí Nén Cong - Có Ren (2995)
Đầu Nối Nhanh Khí Nén Chữ Y (475)
Đầu Nối Nhanh Khí Nén Chữ Y - Có Ren (557)
Đầu Nối Nhanh Khí Nén Chữ T (514)
Đầu Nối Nhanh Khí Nén Chữ T - Có Ren (1790)
Đầu Nối Nhanh Khí Nén Chữ Thập (70)
Đầu Nối Nhanh Khí Nén Lắp Vách (106)
Đầu Nối Khí Nén Kim Loại (1)


















![Ốc Inox 304 là gì? Tất tần tật về Bulong, Vít Inox 304 [Tiêu chuẩn & Phân loại]](http://cms.mecsu.vn/uploads/media/2025/11/bulong dau luc giac inox 304 3.jpg)


